Research
経皮的冠動脈形成術を施行した急性冠症候群患者の急性期および
慢性期の病態解明に関する疫学研究:青森急性冠症候群レジストリー
Aomori ACS Registry
青森県内の急性冠症候群(ACS)患者へ経皮的冠動脈形成術を施行している病院において、既存データを用いた「後向き疫学研究用ACSデータベース」ならびに新規症例登録による「前向き疫学研究用ACSデータベース」を構築し、発症24時間以内に経皮的冠動脈形成術を施行したACS患者の急性期及び慢性期の病態や予後について解析し、ACSの予防や予後改善を目指すことを目的とする。
急性期の経皮的冠動脈形成術による早期再灌流や、脂質管理なども含めた至適薬物療法は予後改善のため日々進歩している。しかしながら、ACSの病態や予後、予防については未だ不明な点も多い。本研究では、青森県内のACS患者のデータベースを構築し、急性期ならびに慢性期のACS患者の疫学ならびに病態や予後に関わる因子などについて検討し、ACSの予防や予後改善を目指すことを目的とする。
共同研究施設
- 弘前大学医学部附属病院
- 青森県立中央病院
- 青森市民病院
- 八戸市立病院
- つがる総合病院
- むつ総合病院
- 三沢市立三沢病院
急性心筋梗塞患者における急性期の致死的合併症、および退院後の心臓突然死の解析
急性心筋梗塞(AMI)は突然死の代表的な疾患のひとつであり、発症後数時間以内に2-3人に1人が亡くなるとされています。その原因の多くは、致死的不整脈である持続性心室頻拍(VT)および心室細動(VF)であると考えられています。AMI急性期に発症したVT/VFの頻度や特徴、予測因子を明らかにするため、2000年4月から2019年3月までに当科へ入院し、発症後12時間以内にPCIを受けた1,941人の患者を後ろ向きに解析しました。当院への到着後から退院までの間に8.3%の患者でVT/VFの発生を認め、そのうち39.8%がVT/VF stormとなり、12.4%が難治性VT/VFのため膜型人工肺(ECMO)による循環補助を必要としました。VT/VFを合併した患者では院内死亡率が有意に高く(22.4% vs 3.3%)、特にPCI後にVT/VFを発症した患者において高値でした(60.6%)。多変量解析では、責任病変が左主幹部、来院時のKillip class II-IVは入院中を通してVT/VF発生の独立した予測因子でした。また来院前のVT/VFの発生、発症後6時間以内の来院、PCI前のTIMI grade 0は、来院からPCI終了までに発生するVT/VFの独立した予測因子である一方、PCI後のTIMI grade 0-2は、PCI後に発生するVT/VFの独立した予測因子でした。生存退院した患者の検討では、入院中のVT/VFの発生(発症48時間以内)は退院後の心臓突然死を含めた予後に影響しないことが明らかになりました。
また、AMI急性期のもう一つの致死的合併症である心破裂について検討しました。心破裂は、AMI発症後12時間以内にPCIがなされた患者の1.3%に発生し、心破裂に起因する死亡は入院中の全死亡の15%を占めました。心破裂を合併した患者の院内死亡率は54%に達し、そのほとんどはBlow-out型の自由壁破裂によるものでした。PCI中に発生した心破裂はすべてblow-out型の自由壁破裂で、心嚢ドレナージやECMOによる循環補助などの治療によっても救命できませんでした。Blow-out型の自由壁破裂の死亡率は92.3%に達しており、過去の報告と一致していました。対照的に、Oozing型の自由壁破裂では、82%の患者が生存退院しています。Oozing型の自由壁破裂を発症した患者の多くは心嚢ドレナージにて循環動態の安定がえられ、外科的修復なしでも管理可能でした。多変量解析によると、70歳以上、PCI前のTIMI grade 0、および前下行枝の責任病変が心破裂の独立した予測因子でした。
次に、AMIを発症し、発症後12時間以内にPCIがなされ、生存退院した患者を対象として、退院後の心臓突然死を含む長期予後について検討しました。2005年4月から2019年3月までの期間に、退院前に左室造影や心エコーで左室駆出率(LVEF)が測定された患者1,429人を対象としました。心臓突然死は、LVEF 35%以下では1年で2.6%、3年で3.1%の患者に発生しました。一方で、退院時のLVEFが35%より大きい患者では、心臓突然死は1年で0.1%、3年で0.3%と非常に低率でした。重要なことは、LVEF 35%以下の患者においては、突然死の67%は退院後4か月以内に発生したことです(図)。
Sudden cardiac death + VT/VF
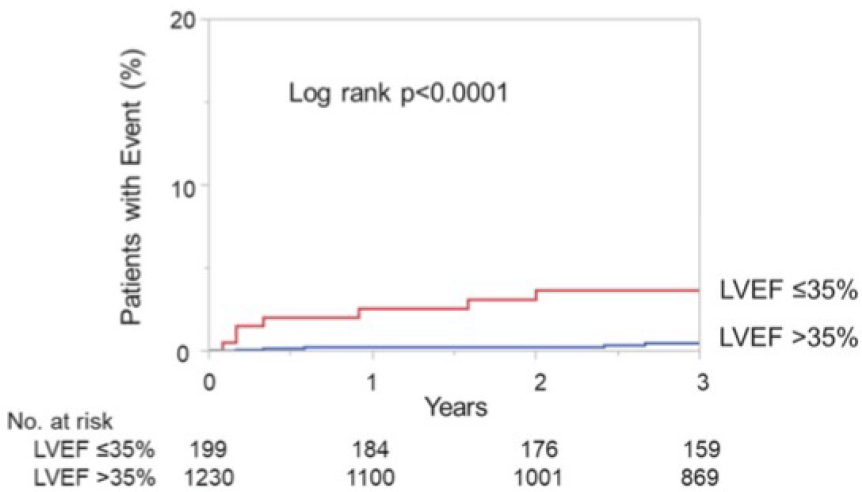
多変量解析では、退院時のLVEF 35%以下は独立した突然死の予測因子でした。日本人のAMI患者においては、退院後の突然死は非常に少ないものの、LVEF 35%以下の患者においては、退院後数か月間は特に注意深い診療が必要と考えられました(Circ J 2022)。
虚血性心疾患患者における植込み型除細動器移植後の適切作動とその予測因子の検討
虚血性心疾患において、左室駆出率(LVEF)が低下した患者においては致死的不整脈による心臓突然死が発生する危険性が高くなると考えられており、一次予防として植込み型除細動器(ICD)が検討されます。また、致死的心室性不整脈から蘇生された患者では、二次予防としてICDの適応が検討されます。しかしながら、日本人においてICD移植術後の適切作動の頻度や、その予測因子などについては明らかにはなっていません。2005年1月から2022年10月まで、虚血性心疾患を有するICD移植術が行われた141人を対象として研究を行いました。56人は一次予防として、85人は二次予防としてICDが移植され、平均5.3年の経過観察を行いました。一次予防では84%の患者がLVEF 30%以下であり、残りの16%はLVEF 35%以下でNYHA II or IIIの心不全症状を有していました。二次予防では、ICD移植前の致死的不整脈として61%の患者で持続性心室頻拍(VT)が、39%で心室細動(VF)が捕捉されていました。以上より、すべての患者はACC/AHAガイドラインのICDのclass Iの適応を満たしていました。LVEFは、二次予防の患者と比較して一次予防の患者で有意に低下していました(25.6±5.6 vs 35.5±11.0%)。観察期間中の総死亡、心臓死は、一次予防、二次予防の患者間で差は認めませんでした。適切作動の頻度も一次予防、二次予防で差はありませんでしたが、二次予防においては、初めの数年間に比較的多く作動を認めました(図1)。二次予防の患者においては、ICD移植前の致死的不整脈がVTだった患者では、VFだった患者に比べて明らかに適切作動を多く認めました(Long rank p=0.0001) (図2)。
図1 Appropriate ICD therapy
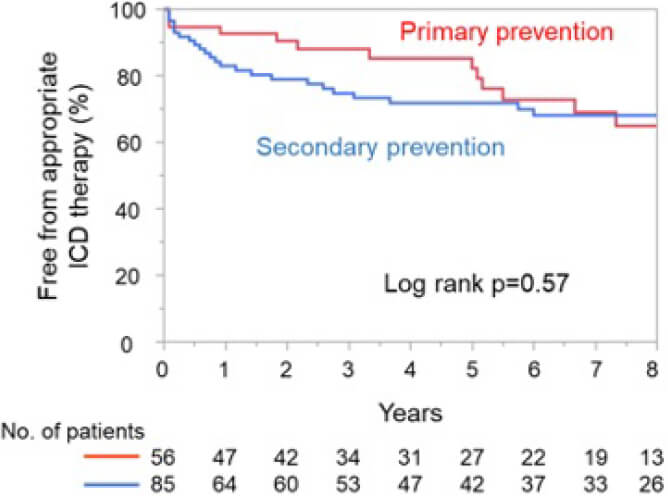
図2 Appropriate ICD therapy

多変量解析では、ICD移植前の致死的不整脈がVTであることは、適切作動の独立した予測因子でした。また、観察期間中に適切作動を経験した37人の患者において、22人が二回目の適切作動を経験しました。そのうち半数の例では、一回目の適切作動から半年以内に適切作動が起こっていました。以上の結果より、一次予防、二次予防どちらにおいても致死的不整脈、それに続く適切作動はある程度の頻度で発生すること、ICD移植前にVTの発生が捕捉されている例ではICDの適切作動の可能性が比較的高いこと、一度ICDが作動すれば、比較的早期に二回目の作動が起こる可能性が高いため、注意深い治療が必要と考えられることが明らかになりました。
冠攣縮性狭心症の病態解明
当科では長年にわたって、冠攣縮性狭心症(CSA)の成因に関する分子生物学的研究を行っています。この研究はじまりは、臨床例から得た知見でした。CSA患者の心臓カテーテル検査の際に、シースの刺入部より採取した皮膚から線維芽細胞を培養し、血管収縮のkey enzyme であるphospholipase C (PLC) 活性を測定しました。驚いたことにCSA患者の全例で正常者と比較してPLC活性が亢進しており、PLC活性と冠動脈のトーヌスに正の相関を認めることを見出しました。
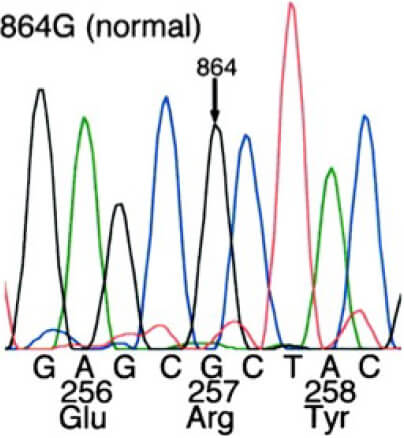
また、細胞膜に存在するその主なisoformはdelta-1 (PLC-delta 1)であることを発見しました (Okumura, et al. J Am Coll Cardiol 2000)。PLC活性亢進の成因を探るためにCSA患者においてPLC-delta 1の遺伝子解析を行ったところ、257番目のアミノ酸であるアルギニンがヒスチジンへ置換するR257H亜型を発見しました(図1)。その機能解析ではR257H亜型のPLCではPLC活性が亢進しており、細胞内Caイオン濃度の上昇が亢進することを見出しました(Nakano, et al. Circulation 2002)。
図1

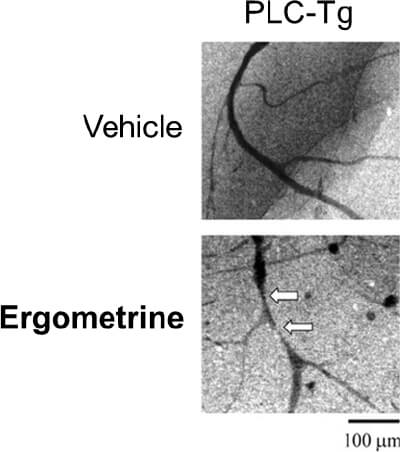
これらの臨床例から得られた知見を動物モデルにて解析するため、変異型PLC-delta 1(R257H)を血管平滑筋細胞において過剰発現させたトランスジェニックマウス(PLC-Tg)を作製しました。臨床で実際にCSAの診断に用いられている血管収縮薬(エルゴメトリン)を経静脈的に投与したところ、PLC-Tgでは体表心電図にてST上昇を認め、完全房室ブロックに至りました(図2、矢印)。また、エルゴメトリン投与後の冠動脈を観察したところ、PLC-Tgマウスでは冠動脈に攣縮を認めました(図3、矢印)。これらのPLC-Tgマウスを用いて得られた新たな知見は、臨床例に即した冠攣縮性狭心症の動物モデルとして世界で初めての報告であり(Shibutani, et al. Circulation 2012)、CSAの成因の解明において非常に有用な知見と考えられます。
図2
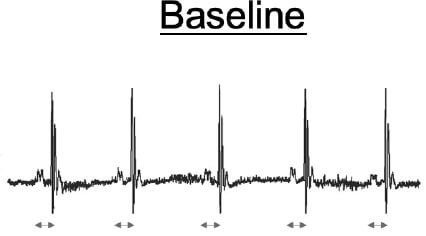
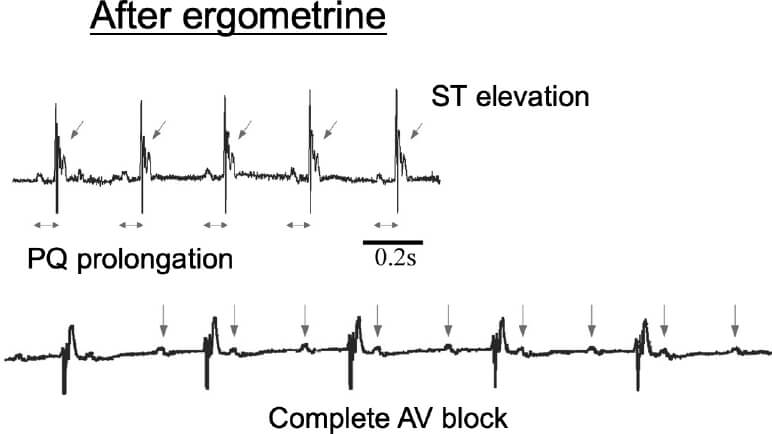
図3
これらの我々のCSAのメカニズムに関する研究成果は、世界的に有名な循環器病学の教科書であるBraunwald のHeart Disease (9th edition, Chapter 56, 1196ページ) にも、以下のように記載されています。(Prinzmetal variant anginaは、冠攣縮を特徴とするST上昇を伴った安静狭心症(異型狭心症)の別名です)
The precise mechanisms responsible for Prinzmetal variant angina have not been established, but a reduction in nitric oxide production by the coronary arterial endothelium or an imbalance between endothelium-derived relaxing and contracting factors may prevail. Enhanced phospholipase C (PLC) activity has also been documented. Because PLC (through activation of the inositol triphosphate pathway) mobilizes Ca from intracellular stores, it may enhance contraction of smooth muscle cells (Okumura K et al, J Am Coll Cardiol 2000).
さらに、PLC-delta 1におけるR257H変異に関連したCSAの発症機序に関する研究として、PLC-delta 1の活性化因子であるp122に着目しました。p122のプロモーター遺伝子の変異によりp122の活性が亢進すること、この変異は男性のCSA患者で多くみられることを見出しました。また、CSA患者より採取、培養した皮膚線維芽細胞においてp122の遺伝子、および蛋白の発現の亢進を認めました。冠動脈平滑筋細胞を用いた実験では、p122を過剰発現させることにより、アセチルコリンによる細胞内Caイオン濃度の上昇が亢進し、逆にp122、あるいはPLC-delta 1のノックダウンにより細胞内Caイオン濃度の上昇は抑制されました(図4) (Murakami, et al. Arterioscler Thromb Vasc Biol 2010)。さらに、血管平滑筋細胞特異的にp122を過剰発現させたマウスにおいて、細胞膜のPLC活性は亢進しており、PLC-Tgマウスと同様にエルゴメトリンにより冠攣縮が誘発されました。(Kinjo, et al. PLoS One 2015)。
図4
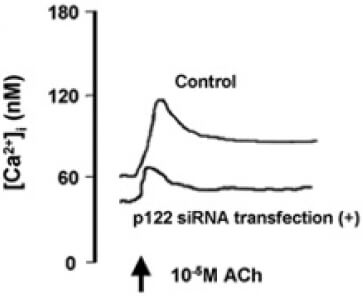
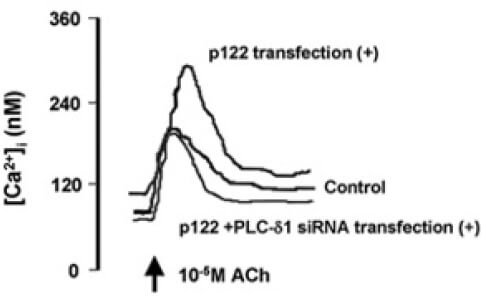
また、臨床において冠攣縮性狭心症の治療薬として確立しているCa拮抗薬の作用機序の解明にも取り組みました。ジルチアゼムをPLC-Tgマウスに投与したところ、エルゴメトリンの投与による冠攣縮が抑制され、その機序としてカルシウムチャネルの主要な構成タンパクであるCav1.2のリン酸化、およびProtein Kinase Cの活性亢進が抑制されることを発見しました。さらに、ジルチアゼムの投与によってCav1.2タンパクの発現が有意の増加し、ジルチアゼムの中止後もそれは持続していました。実臨床においては、時にカルシウム拮抗薬の中断により強い冠攣縮が起こるカルシウム拮抗薬離脱症候群が問題となりますが、Cav1.2タンパクの発現の上昇は、この現象の原因となっている可能性が示唆されました(Ishida et al. Int Heart J 2021)。さらに、細胞内Caイオン濃度の上昇の亢進によらない、Caイオン非依存性の冠攣縮の機序について、カルシウム感受性に着目して研究を継続しています。これは、薬剤抵抗性の難治性冠攣縮の成因となっている可能性があるのではないかと考えています。
さらに、CSA患者の検体よりiPS細胞を樹立し、それから血管平滑筋細胞を分化誘導させ、アセチルコリンに対する細胞内Caイオン濃度の測定や、細胞内シグナリングの解析、およびCa拮抗薬などの治療薬に対する効果などについて、現在研究をすすめているところです。
これらの臨床研究、基礎研究から得られた多くの知見は、冠攣縮性狭心症、および冠攣縮に起因する急性心筋梗塞や心臓突然死の病態の解明にもつながり、臨床的に大きな意義を有すると考えられます。このように、基礎研究で終わるのではなく、臨床例より得た知見を基礎研究で解析、検討し、それをさらに臨床例に応用していく、いわゆるトランスレーショナルリサーチを実践しています。
高血圧性心肥大、腎障害におけるACE2/Ang(1-7)/Mas受容体を介した保護作用
レニン・アンジオテンシン系は血管抵抗や塩分の再吸収などを調整することによって、体血圧や体液量の調節に主要な役割を果たしていることはよく知られています。その中でも、特にアンジオテンシンⅡは、心筋細胞を含む全身の細胞レベルで直接に作用して、炎症や線維化をもたらすことが明らかになっています。アメリカのUniversity of North Carolina, Chapel Hill校のOliver Smithies研究室より供与されたレニン過剰発現マウス(Renin-Tg)は、肝臓からレニンが過剰に産生される世界的にも珍しいレニン・アンジオテンシ系の亢進による高血圧モデルマウスであり、野生型マウスと比較して収縮期血圧が上昇し、左室肥大、線維化、タンパク尿をきたすことが明らかとなっています。レニン・アンジオテンシ系の亢進に対するアンジオテンシンⅡ受容体拮抗薬の効果を検討するため、Ren-Tgマウスに、アンジオテンシンⅡ受容体拮抗薬であるオルメサルタンを投与しました。オルメサルタンの投与により左室肥大、線維化は抑制され、この心保護的な効果は、血圧非依存性でした(利尿剤によって同程度に血圧を低下させても左室肥大、線維化は抑制されませんでした)。その機序として、オルメサルタンがアンジオテンシンⅡの受容体への結合を阻害したことに加えて、オルメサルタンの投与によってACE2/Ang(1-7)/Mas受容体の発現の上昇、および酸化ストレスの減少を認めました。ACEはアンジオテンシンⅠのC末端から2アミノ酸を切断することによってアンジオテンシンⅡを生成しますが、ACE2はアンジオテンシンⅡからアンジオテンシン(1-7)を生成し、アンジオテンシン(1-7)はMas受容体に結合します。Mas受容体はアンジオテンシンⅡ受容体の活性化に拮抗する効果を有することが報告されており、オルメサルタンはACE2/Ang(1-7)/Mas受容体を活性化させることによって心保護作用をもたらすことを見出しました(Tanno, et al. J Cardiovasc Pharmacol 2016)。また、腎臓においては、Ren-Tgマウスにおいて、オルメサルタンは血圧非依存性に尿中アルブミンを減量させました。そのメカニズムとして、心臓と同様にACE2/Ang(1-7)/Mas受容体を介した機序による腎保護作用が示唆されました(Ichikawa, et al. Int Heart J 2018)。
Protease-activated receptor (PAR)阻害薬による
高血圧性心肥大、腎障害の進行の抑制
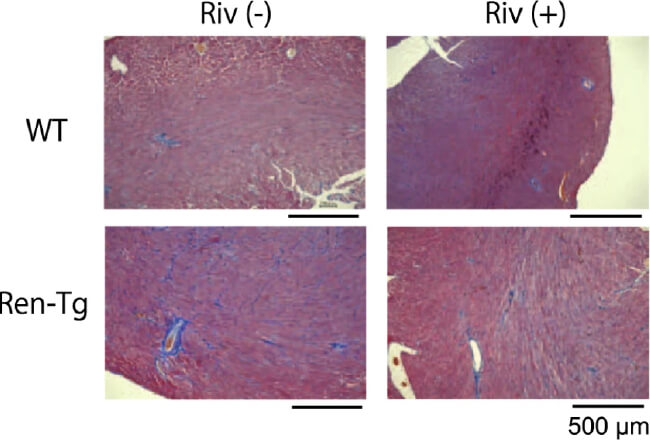
心房細動による全身性塞栓症の予防として広く用いられている直接作用型抗凝固薬(direct oral anticoagulant, DOAC)は、凝固カスケードの一つである第X因子(Factor Xa)を阻害することによって作用を発揮します。Factor Xaは凝固因子としての作用の外に、細胞膜表面に存在するProtease-activated receptor (PAR)に結合することによって、炎症を惹起することが報告されていますが、その心不全、腎障害の進行における役割についてはわかっていません。そこで、DOACの一つであるリバロキサバンをRen-Tgマウスに投与し、心不全、腎障害の進行への効果を検討しました。Ren-Tgマウスでは、野生型マウスと比較して血中のFactor Xa活性が有意に亢進しており、リバロキサバンの投与により抑制されました。またリバロキサバンの投与によりRen-Tgマウスの左室肥大、線維化が抑制されました(図1)。
図1
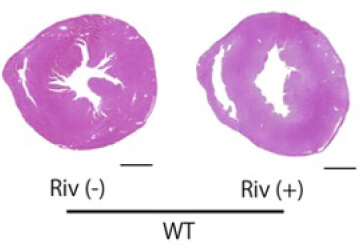
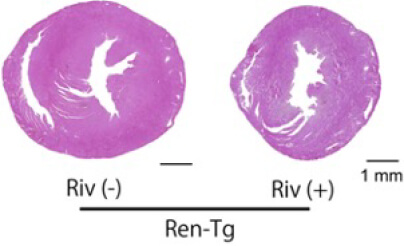
その機序として、心臓においてTNFαやTGFβなどの炎症性サイトカインの発現が抑制されていました。リバロキサバンによる心保護作用の機序を検討するため、Factor XaはPAR-2を活性化させる作用を有していることから、Ren-TgマウスにPAR-2阻害薬を投与しました。PAR-2阻害薬の投与によって、リバロキサバンと同様に左室肥大が抑制され、心臓の炎症性サイトカインの発現が抑制されました。さらに、マウスの心臓から単離した心筋線維芽細胞を用いた実験では、リバロキサバン(Riv)とPAR-2阻害薬(FSLLRY)は、どちらもFactor XaによるERKの活性化を抑制し、心筋線維芽細胞の分裂、増殖を抑制しました。
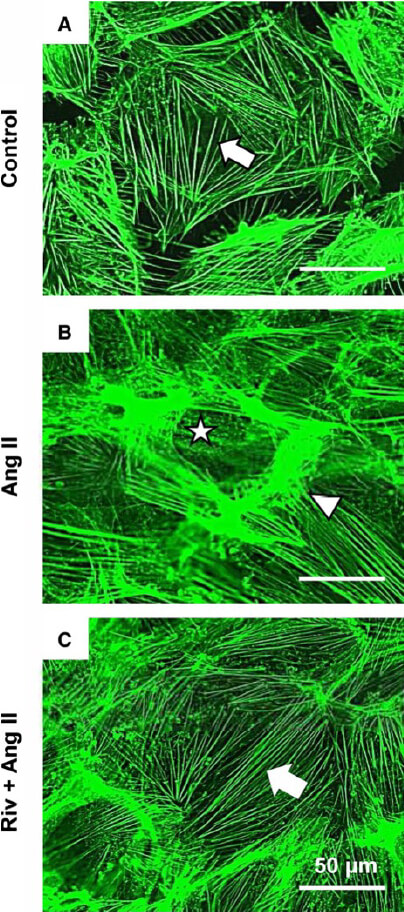
また、高血圧性腎障害の進行に対するリバロキサバンの効果について検討しました。Ren-Tgマウスでは、野生型マウスと比較して尿タンパクが有意に増加していたのに対し、リバロキサバンの投与によって尿タンパクは減少し、腎臓のTNFαやTGFβなどの炎症性サイトカインの発現が低下していました。組織学的な検討によると、Ren-Tgマウスでは糸球体の肥大、メサンギウム領域の拡大、podocyteの足突起の癒合、および糸球体基底膜の肥厚を認めましたが、リバロキサバンの投与によってそれらの変化は抑制されていました(図2)。Podocyteを用いたin vitroの研究では、アンジオテンシンⅡの刺激によって炎症性サイトカインは増加し、細胞骨格の破壊を認めましたが、リバロキサバンの投与、またはPAR-2のノックダウンによりそれらの変化は抑制されました(図3) (Ichikawa, et al. J Am Heart Assoc 2019)。
図2
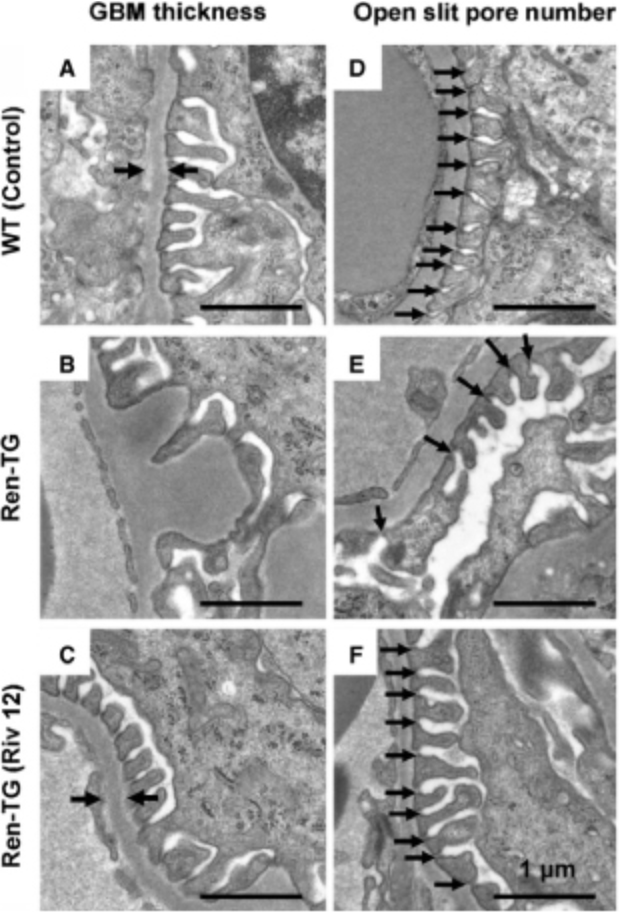
図3
以上の2つの研究は、Factor XaのPAR-2を介した作用に着目して行いましたが、次に高血圧モデルにおけるPAR-1の役割について検討しました。Ren-Tgマウスにおいては、血中のFactor Xaのみならず、PAR-1のアゴニストであるThrombinの前駆体であるProthrombin fragment 1+2の濃度が上昇していました。Ren-TgへのPAR-1阻害薬の投与により、左室肥大および線維化が抑制されました。その機序として、炎症性サイトカインの増加がPAR-1阻害薬によって抑制され、左室への炎症性マクロファージの浸潤も低下していました。マウスの心臓から単離した心筋線維芽細胞を用いた実験では、ThrombinとFactor XaはどちらもERKのリン酸化を亢進させ、PAR-1阻害薬はそれらを抑制しました(Yokono, et al. J Am Heart Assoc 2020)。
当研究室から発表されたこれらのPAR-1、PAR-2の新たな知見は、凝固カスケードの心肥大、腎障害の進行における重要性を明らかにすると同時に、臨床で広く使用されているDOACの副次的な保護作用、潜在的な臨床的有用性を示唆するものです。
心血管系の病態生理におけるβアレスチンの役割の解明
Gタンパク共役受容体(G-protein coupled receptor, GPCR)は、細胞膜に存在する7回膜貫通型の受容体であり、細胞外のホルモンや神経伝達物質などによって活性化されます。GPCRは全身の様々な臓器、細胞に分布し、様々な生理的、病的作用に関与しています。現在臨床において使用されている治療薬の約4割がGPCRを標的としたもので、現在も創薬の主要なターゲットの一つとなっています。心血管系においては、アンジオテンシンII受容体やβアドレナリン受容体、ムスカリン型アセチルコリン受容体やエンドセリン受容体など多くの受容体がGPCRです。βアレスチンは、GPCRにおいてGタンパクとは別のシグナル伝達の活性化に不可欠なメディエーターとしての役割が注目されており、様々な受容体、様々な疾患において研究が行われています(Nature 2018)。例えば、心筋細胞のβ1アドレナリン受容体(β1AR)では、アゴニスト(カテコラミン)が受容体に結合すると、G-proteinがAdenylyl cyclaseを介してcAMPを増加させ、心収縮力の増強や心拍数の増加をもたらしますが、一方で慢性的な活性化は心収縮力の低下や心拡大、線維化をもたらします(図)。

βアドレナリン受容体拮抗薬のひとつであるカルベジロールは、G-proteinを抑制すると同時に(アンタゴニストとしての作用)、βアレスチンを介したシグナル伝達を活性化させ(アゴニストとしての作用)、抗アポトーシス効果、心保護作用をもたらすことが報告されています(J Clin Invest 2007)。さらに、βアレスチンはFlank-Starlingの機序や(Proc Natl Acad Sci U S A 2016)、心筋細胞からのエクソソームの分泌(Circulation 2015)など、重要な心血管系の病態生理に関与していることが明らかになってきています。
TRV120023はアンジオテンシンⅡ受容体と結合し、Gタンパクは活性化させずにβアレスチンの経路のみを活性化させるアゴニストであり(Biased agonist)、アンジオテンシンⅡ受容体拮抗薬と同様、アンジオテンシンⅡとアンジオテンシンⅡ受容体を競合します。アンジオテンシンⅡの持続投与による高血圧モデルマウスにおいて、TRV120023の効果を検討しました。アンジオテンシンⅡの持続投与は、収縮期血圧を有意に上昇させましたが、TRV120023はアンジオテンシンⅡによる血圧上昇を抑制しました。また、アンジオテンシンⅡの持続投与により左室肥大、線維化を認めましたが、TRV120023はそれら抑制しました。以上より、アンジオテンシンⅡ受容体におけるbiased agonistであるTRV120023は、アンジオテンシンⅡに拮抗することによって、アンジオテンシンⅡによる左室肥大、線維化を抑制し、心保護的に作用することが明らかになりました。今後、さらなる検討を行っていく方針です。また、肺動脈性肺高血圧症におけるβアレスチンの役割についても、in vivo、in vitroの系で検討を行っています。